
题目列表(包括答案和解析)
| A、c(X2)=0.15 mol?L-1 | B、c(Y2)=0.9 mol?L-1 | C、c(Z2)=0.3 mol?L-1 | D、c(Q2)=0.5 mol?L-1 |
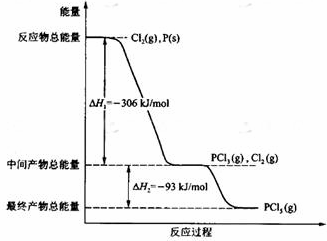 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:(14分)实验题:某班级的探究小组研究氧化铜能否在氯酸钾的受热分解中起到催化剂的作用,设计了如下实验:
(一) 制备氧化铜
(1)称取5.0gCuSO4·5H2O晶体,研细后溶解:此步骤需要的仪器有________________________。
(2)向盛有硫酸铜溶液的烧杯中滴加NaOH溶液,直到不再产生沉淀为止。此步实验现象:____________;离子方程式为:_________________。
(3)A.把步骤(2)中的溶液和沉淀转移到蒸发皿内,稍微加热至沸腾,搅拌,直到沉淀全部变为黑色固体,停止加热,再过滤、洗涤、干燥、再转移到研钵中研细备用。
B.把步骤(2)中的溶液和沉淀转移到过滤器中过滤,洗涤,将上述沉淀在蒸发皿中进行蒸发,至全部变为黑色固体为止。再转移到研钵中研细备用。
你认为那一个步骤更好,说明理由:______________________。
(二) 证明氧化铜起催化剂作用
设计对比实验①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的ng氧化铜粉末;②将两份氯酸钾同时在相同条件下正确加热,将放出的气体通入水中;③停止加热,冷却,将原先混有氧化铜的反应后混合物加水溶解,小心过滤,得到滤出物,洗涤并干燥;④观察滤出物的颜色和状态;⑤将滤出物和炭粉混和,在密闭容器中高温加热,将反应产生的气体通入澄清的石灰水中,并观察试验现象。
请回答下列问题:
(1)氧化铜作催化剂的理论依据是:_____________________。
(2)以上实验步骤,有一步不够严密,请指出是那一步:______(填步骤序号);该步骤应该做何改进?__________________。
(3)要达到实验目的,还应该再增加一个实验步骤,这个实验步骤是______。
(4)若用另一套实验装置和操作替换第⑤步实验,也可以达到这一步的实验目的,请从图中所给的仪器作出合理选择,将它们连接成一个符合设计者要求的试验装置。
这个实验装置按照气流从左到右的连接顺序是__接__接__接__接__接__。
(10分) 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
(6分)在密闭容器中进行如下反应:mA(g)+nB(g)  pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
(1)写出上述化学方程式中各物质的计量数:m=________,n=________,p=________
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示。由此可知,该反应为 (填“吸热”或“放热”)反应。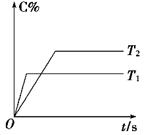
(3)该反应的平衡常数表示式为 ,升高温度,K值将 (填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com