
题目列表(包括答案和解析)
A.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.(1)该反应的化学方程式为________,生成物NF3中氮原子的杂化方式为________,NF3分子空间构型为________;
(2)N、F两种元素的氢化物稳定性比较,NH3________HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式________;
(4)元素A基态原子的核外电子排布式为
1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如图,该离子化合物的化学式为________.
B.绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓.其流程可表示为:
(1)洗涤中Na2CO3的主要作用是________.
(2)结晶过程中要加热蒸发溶剂,浓缩结晶.应加热到________时,停止加热.
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是________.
(4)用无水乙醇洗涤的目的是________.
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法.称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2 mol/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00 mL.
①本实验的指示剂是________.(填字母)
A.酚酞
B.甲基橙
C.石蕊
D.不需要
②产品中Fe2+的质量分数为________.
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
 请回答下列问题:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在_____________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。
(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸 b.碳酸氢钠粉末 c.红色石蕊试纸 d.银氨溶液
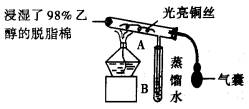
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为_____________________________.
(2)从A管中可观察到的实验现象为________________________________________.由此可以认识到该实验过程中催化剂起催化作用时参加了化学反应,还可以认识到催化剂起催化作用时需要一定的____________________.
(3)实验一段时间后,如果撤掉酒精灯,反应__________(继续或停止)进行,原受热的铜丝最终为__________色.
(4)验证乙醇氧化产物的化学方法是________________________________________.
(12分)某化学实验小组拟用以下装置由乙醇与浓硫酸共热制备乙烯,且进行乙烯的催化氧化实验。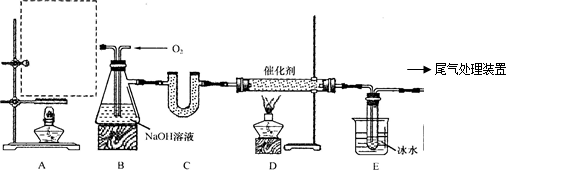
(1)在A处虚线框内绘出该实验装置图。
(2)制取乙烯的化学方程式为 。
(3)装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:
① ;② 。
(4)若E中收集到的物质为CH3CHO,则D中发生反应的化学方程式为 。
(5)用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是 (填字母序号)。
A.乙醇部分挥发 B.乙醇部分生成乙醚
C.乙醇被氧化为C、CO、CO2 D.乙醇消去成乙炔
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com