
题目列表(包括答案和解析)
 2HI (g) △H<0 反应速率的影响,设计下表所示实验
2HI (g) △H<0 反应速率的影响,设计下表所示实验
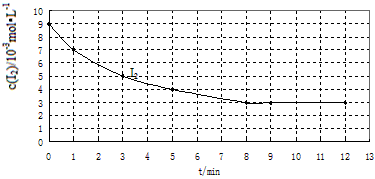
(12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 ;
(2)25℃时,反应2CO2 (g)2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3) 1 600℃时,反应2CO(g)+O2(g) 2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为 ;
(4) 以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式 。
(12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 ;
(2)25℃时,反应2CO2 (g)2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3) 1 600℃时,反应2CO(g)+O2(g) 2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为 ;
(4) 以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式 。
(12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 ;
(2)25℃时,反应2CO2 (g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是 。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图: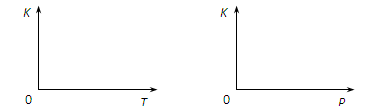
(3) 1 600℃时,反应2CO(g)+O2(g)  2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为 ;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为 ;
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式 。
(12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 ;
(2)25℃时,反应2CO2 (g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是
。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
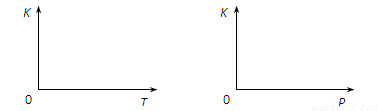
(3) 1 600℃时,反应2CO(g)+O2(g)  2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为
;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为
;
(4) 以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com