
题目列表(包括答案和解析)
| MgO | Al2O3 | MgCl2 | AlCl3 |
熔点/℃ | 3852 | 2072 | 712 | 90 |
沸点/℃ | 3600 | 1418 | 180 | — |
(1)工业上常用电解熔融MgCl2方法制金属镁,电解Al2O3的方法生产铝。为什么不用电解熔融MgO方法制金属镁,也不用电解熔融AlCl3的方法生产铝?
答:________________________________________________。
(2)设计一个方案证明MgCl2和AlCl3的晶体类型。其实验方法是_________________________。
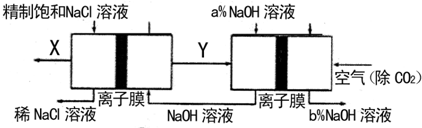
(11分)请仔细阅读下图和文字说明,回答后面提出的问题:
![]()

右图所示的区域包括三个市区,一个氯碱制造厂,一个废水处理厂和一个火力发电厂,两个厂都向河里排放污水。
![]() (1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
(1)火力发电厂使用的燃料煤中含有少量的硫,燃烧的气体未经处理即排放到空气中,又有部分发电用水未经冷却排入附近的河中,经观察其下游几十公里范围内的河水中鱼类几乎绝迹,其原因是 。
![]() (2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
(2)由于SO2是形成酸雨的罪魁祸首之一。近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品。请参照酸碱盐的转化关系,按顺序写出上述两步反应的化学方程式: ;。
![]() (3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(3)火力发电厂的电能输送到氯碱制造厂进行NaOH、Cl2和H2的制备。如果氯碱厂采用电解饱和食盐水的方法,则反应方程式为 ,NaOH将在电解装置的 极产生,可用下列最简单的化学方法证明电解时生成NaOH 。
(4)科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱制造厂进行横向联合。请你判断该方案是否可行? ;如果可行,请简述该方案的优点是 ,如果涉及到化学反应,其化学反应是 。
(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
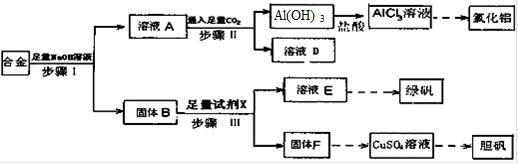
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液D中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是 。
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是 。
(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。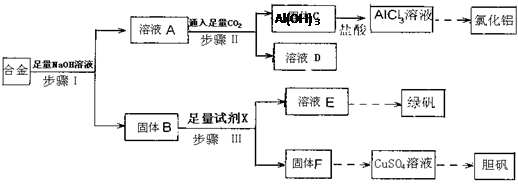
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液D中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是 。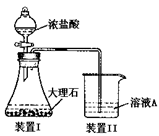
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com