
题目列表(包括答案和解析)
已知25℃时0.1![]() 醋酸溶液的pH值约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液pH值增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了
醋酸溶液的pH值约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液pH值增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了![]() ,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使
,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小,因此溶液pH值增大.你认为上述两种解释中________(“甲”或“乙”)正确.
减小,因此溶液pH值增大.你认为上述两种解释中________(“甲”或“乙”)正确.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1![]() 的醋酸溶液中加入少量下列物质________(填写编号),然后测定溶液的pH值.
的醋酸溶液中加入少量下列物质________(填写编号),然后测定溶液的pH值.
[ ]
A.固体![]()
B.固体![]()
C.气体![]()
D.固体![]()
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH值应________(填“增大”、“减小”或“不变”).
(已知:25℃时,0.1![]() 氨水的电离度为1.3%,0.1
氨水的电离度为1.3%,0.1![]() 醋酸的电离度为1.3%)
醋酸的电离度为1.3%)
| A.c1>c2 | B.a1<a2 | C.碱性:甲<乙 | D.无法判断 |

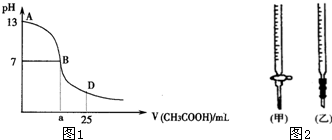
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?___________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?___________区间(若正确,此问不答)。
(2)关于该滴定实验,从下列选项中选出最恰当的一项___________。(选填字母)

| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 甲基橙 | (甲) |
C | 碱 | 酸 | 酚酞 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是________。
A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)___________2c(Na+)。(填“>”“<”或“=”)
Ⅱ.t ℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13:
(5)该温度下水的离子积常数KW的数值为___________。
(6)该温度下(t ℃),将100 mL 0.1 mol·L-1的稀硫酸溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________。
| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com