(2010?宣武区二模)为减小和消除CO
2对环境的影响,有科学家提出“绿色自由”构想.即先把空气吹入碳酸钾溶液,然后再把CO
2从溶液中提取出来,并使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:

(1)写出分解池中反应的化学方程式
.
(2)在合成塔中,当有4.4kg CO
2与足量H
2完全反应,可放热4947kJ,写出合成塔中反应的热化学方程式
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ/mol
.
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.
当电子转移为
1.2
1.2
mol时,参加反应的氧气的体积是6.72L(标准状况下).
(4)在容积为1L的密闭容器中,充入1mol CO
2和3mol H
2,在500℃下发生反应.有关物质的浓度随时间变化如图所示.
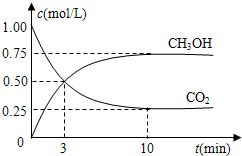
①从反应开始到平衡,H
2的平均反应速率v(H
2)=
0.225 mol/(L?min)
0.225 mol/(L?min)
.
②若其它条件不变,只将温度提高到800℃,再次达平衡时,
比值
减小
减小
(填“增大”、“减小”或“不变”).

 在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了
在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了