
题目列表(包括答案和解析)
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度。现用粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品进行实验。实验装置如图所示(固定装置未画出):

(1)该反应的离子方程式为 。
(2)某学生欲用11.9 mol/L 浓硫酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀硫酸。该学生需要用量筒量取 mL上述浓硫酸进行配制。
(3)实验时除需测定粗锌的质量、氢气的体积之外,是否还需要其他物理量?如需要,请指出____________________,否则,此空不填。
(4)在加入药品之前需检查装置气密性,如何检查该装置的气密性:
。
(5)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是:________________________(请填写步骤代号)。
(6)如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(用含a、b的代数式表示,不必化简):___________________。
(7)请提出另一种更简捷的实验方案:________________________________。
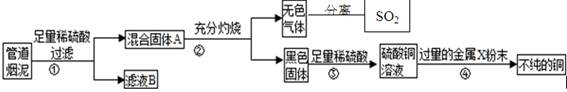
某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示: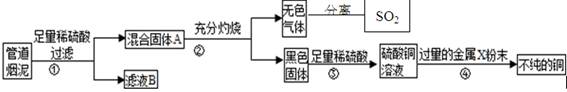
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是 ;如何确定硫酸已经过量 。
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是 ,有关反应的化学方程式 。
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有 (填标号)。
a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液.
(4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下: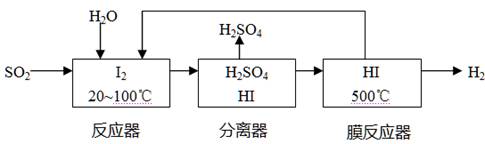
试写出反应器、膜反应器中的化学反应方程式 、 。
某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示:
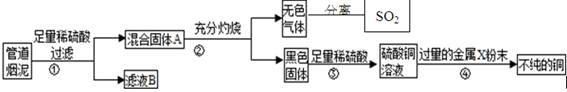
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是 ;如何确定硫酸已经过量 。
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是 ,有关反应的化学方程式 。
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有 (填标号)。
a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液.
(4)将分离出的SO2通过下列碘循环工艺过程既能制H2SO4,又能制取H2,其流程如下:
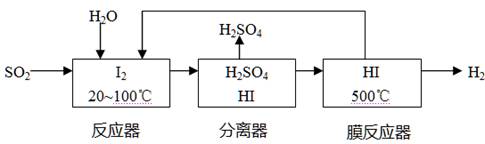
试写出反应器、膜反应器中的化学反应方程式 、 。

| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com