
题目列表(包括答案和解析)
常温下,将等体积的0.1 mol/L的氨水和0.1 mol/L的NH4Cl溶液混合,若忽略混合后溶液的体积变化,下列说法错误的是
A.混合后,NH4Cl对氨水的电离起抑制作用
B.混合后,氨水对NH4Cl的水解起抑制作用
C.c(NH![]() )+c(NH3?H2O)+c(NH3)=0.1 mol/L
)+c(NH3?H2O)+c(NH3)=0.1 mol/L
D.若c(OH![]() )>c(H+),则c(Cl
)>c(H+),则c(Cl![]() )大于c(NH
)大于c(NH![]() )
)
|
常温下,将不同浓度的氨水与盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,则下列说法不正确的是
| |
| [ ] | |
A. |
0.1 mol/L氨水的pH<13,第1组中X<7 |
B. |
第2组中c1>0.2,混合后溶液中c(Cl-)=c(NH4+) |
C. |
第3组混合后溶液中离子浓度由大到小的排列顺序是c(OH-)>c(Cl-)>c(NH4+)>c(H+) |
D. |
采取①加少量水、②加入少量浓盐酸、③加入少量NH4Cl固体的措施,都可以使 0.1 mol/L氨水中c(NH4+)/c(NH3·H2O)增大 |
常温下有浓度均为0.5 mol·L-1的四种溶液:
①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水.
请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是________(填序号,下同),在发生水解反应的溶液中pH最大的是________.
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是________.
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值________(填“增大”或“减小”或“不变”)
的值________(填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
________________________________________________________.
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=________.
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是:![]() △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。
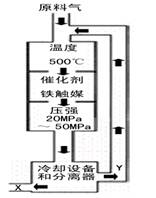
①X的化学式为 ;
②右图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③若升高温度,达新平衡时,平衡常数将__________(填增大或减小或不变)。
④改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) ;

(2)常温下氨气极易溶于水,其水溶液可以导电。
⑤用方程式表示氨气溶于水且显弱碱性的过程:
;
⑥氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑦将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为 。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。


①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com