A、B、D、E、Y为5种短周期元素.
①A、B、D位于同一周期,D、Y位于同一主族.A的原子的最外层电子数是其次外层电子数的2倍.
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属.
请回答:
(1)AD
2中具有的化学键的类型是
极性共价键
极性共价键
.
(2)高温时,6g A的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75kJ,其反应的热化学方程式是
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
.
(3)D与氢元素可组成含有10个电子的X
-,与X
-组成元素相同,原子数个数比也相同的分子的电子式是
.
(4)将盛有一定量红棕色气体BD
2的4L容器压缩至2L,待气体颜色不再变化时,容器内的压强(填“大于”、“等于”或“小于”)
小于
小于
原来的2倍,原因是
2NO2?N2O4为可逆反应,当将其体积压缩为原来的一半时,平衡向右移动,容器内气体分子总数减少,容器内压强小于原来的2倍
2NO2?N2O4为可逆反应,当将其体积压缩为原来的一半时,平衡向右移动,容器内气体分子总数减少,容器内压强小于原来的2倍
.
(5)E的某种化合物可用作净水时的混凝剂,其原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.
(6)YD
2气体通入足量BaCl
2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是
3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+2NO↑+4H+
3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+2NO↑+4H+
.

![]() C(g)+D(g),在一定温度下达到平衡时,其平衡常数的表达式正确的是 ( )
C(g)+D(g),在一定温度下达到平衡时,其平衡常数的表达式正确的是 ( )![]() B.
B.![]() C.
C.![]() D.
D.![]()


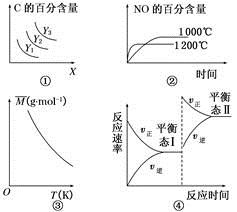
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体