
题目列表(包括答案和解析)
已知:金刚石、石墨的热化学方程式:
C(s,金刚石)+O2(g) =CO2(g) ∆H = -395.4 kJ/mol
C(s,石墨)+O2(g) =CO2(g) ∆H = -393.5 kJ/mol
则石墨转化为金刚石的反应热∆H= ,两物质中 较为稳定 。
已知三个热化学方程式:
(1)I2(g)+H2(g)??2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)??2HI(g) ΔH=+26.48 kJ·mol-1
(3)C(石墨,s)=C(金刚石,s) ΔH>0
下列判断正确的是?? ( )。
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(2)的反应物总能量比反应(1)的反应物总能量低
D.金刚石比石墨稳定
已知25℃、101kPa下,如右题图所示,石墨的燃烧热为393.51kJ/mol,金刚石的燃烧热为395.41kJ/mol 。下列说法或表达正确的是:
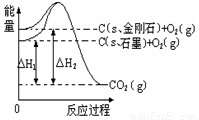
A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| D.金刚石比石墨稳定 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com