
题目列表(包括答案和解析)
(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式 。
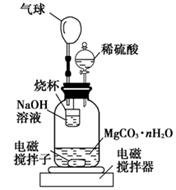
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。

①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用 为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会 (填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
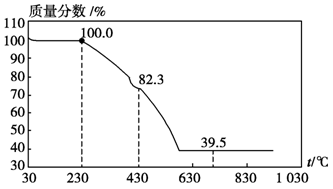
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n= (选填1、2、3、4、5)。
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |

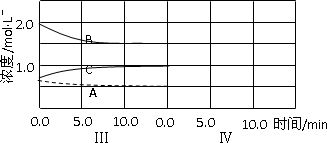
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________。
(3)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是__________________________。
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低: T2________T3(填“>”、“=”、“<”),判断的理由是__________________________。
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

反应aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
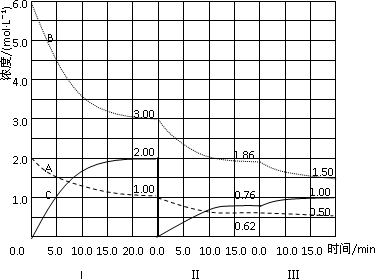
回答问题:
(1)反应的化学方程式中,a∶b∶c为________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”“<”“=”),判断的理由是________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com