
题目列表(包括答案和解析)
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。某高分子化合物F可用下列反应 制得:
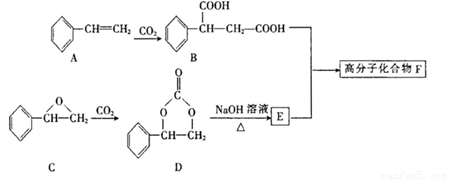
(1) A的名称为________,B的分子式为________。
(2) E中官能团的名称为_______,由A也可以制取E,其发生反应的反应类型依次为___________
(3) 髙分子化合物F的结构简式为________。
(4)G是C的一种同分异构体,其分子中含一个苯环,苯环上的一氯代物有三种,且能发生银镜反应,则G的结构简式为________ ,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为________________________
(5)下列关于冇机物D或E的说法中,正确的有________。
A.D是烃的衍生物,属于芳香族化合物
B.D分子中所有的氢原子有可能在同一平面内
C.E的核磁共振氢谱有4个吸收峰
D.E能发生加成反应、取代反应和消去反应
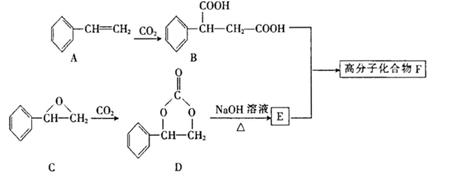
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。某高分子化合物F可用下列反应 制得:
(1) A的名称为________,B的分子式为________。
(2) E中官能团的名称为_______,由A也可以制取E,其发生反应的反应类型依次为___________
(3) 髙分子化合物F的结构简式为________。
(4)G是C的一种同分异构体,其分子中含一个苯环,苯环上的一氯代物有三种,且能发生银镜反应,则G的结构简式为________ ,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为________________________
(5)下列关于冇机物D或E的说法中,正确的有________。
| A.D是烃的衍生物,属于芳香族化合物 |
| B.D分子中所有的氢原子有可能在同一平面内 |
| C.E的核磁共振氢谱有4个吸收峰 |
| D.E能发生加成反应、取代反应和消去反应 |
| A.D是烃的衍生物,属于芳香族化合物 |
| B.D分子中所有的氢原子有可能在同一平面内 |
| C.E的核磁共振氢谱有4个吸收峰 |
| D.E能发生加成反应、取代反应和消去反应 |
Ⅰ
、2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化学物开辟了一个全新的研究领域.在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在.某链烃C7H10c的众多同分异构体中:
(2)
处于同一平面上的碳原子数最多有________.A.
6个B.5
个C.7
个D.
4个(3)
含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有5种.它们的结构简式除(3)含有“手性碳原子”,但与足量
H2发生加成反应后,不具有“手性碳原子”的结构简式是________Ⅱ、
乙烷与某烃的混合气体1.344 L(标准状况)与足量的氧气混合点燃,完全燃烧后所得气体通入300 mL 0.4 mol·L的NaOH溶液中被全部吸收,然后将吸收液低温蒸干,得固体7.6 g.(1)7.6 g
固体的成分是________.(2)
该混合气体中除C2H6外,另一种烃是________.(3)
该混合气体中C2H6,队的物质的量是________,另一种烃的物质的量是________.(4)
若将该混合气体在足量氧气中完全燃烧后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量为________.

| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com