
题目列表(包括答案和解析)
| A、NH3 | B、CH3Cl | C、CO2 | D、H2O |
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.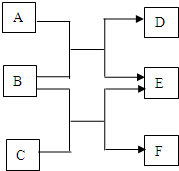 A、B、C、D、E、F六种物质均是由短周期元素组成的中学常见的化学物质.它们之间的转化关系如下图.
A、B、C、D、E、F六种物质均是由短周期元素组成的中学常见的化学物质.它们之间的转化关系如下图.
| ||
| ||


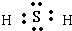
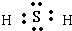
A、B、C、D、E、F和G是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①
A、B、E、F能使湿润的蓝色石蕊试纸变红,G能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色;②
A和G相遇产生白烟;③
B和E都能使品红溶液褪色;④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤C
和D相遇生成红棕色气体;⑥F在D中燃烧可以产生E和H2O.
回答下列问题:
(1)A的分子式是________;
②中白烟的化学式是________,其中的化学键类型为________.(2)
④中发生反应的化学方程式是________.(3)⑤中发生反应的化学方程式是________.
(4)⑥中发生反应的化学方程式是________.
(5)在光照条件下,B(B的组成元素W)和氢气反应过程如下:
①B=W+W
②W+H2=HW+H
③H+B=HW+W……
反应②中形成的化合物的电子式为________;反应③中被破坏的化学键属于________键(填“极性”或“非极性”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com