
题目列表(包括答案和解析)
已知16g硫变成硫蒸汽需要吸收akJ的热量,而2mol硫蒸汽完全燃烧会放出bkJ的热量,则下列热化学方程式正确的是
A .S(s)
+ O2(g) =SO2(g); 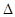 H=-
H=- kJ/mol
kJ/mol
B. S(g)
+ O2(g) =SO2(g); 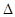 H=-
H=- kJ/mol
kJ/mol
C .S(s)
+ O2(g) =SO2(g); 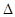 H=-(2a-
H=-(2a- )kJ/mol
)kJ/mol
D .S(s)
+ O2(g) =SO2(g); 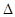 H=-(b-a)kJ/mol
H=-(b-a)kJ/mol
已知16g硫变成硫蒸汽需要吸收akJ的热量,而2mol硫蒸汽完全燃烧会放出bkJ的热量,则下列热化学方程式正确的是
A.S(s) + O2(g) =SO2(g);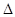 H=- H=- kJ/mol kJ/mol |
B.S(g) + O2(g) =SO2(g);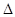 H=- H=- kJ/mol kJ/mol |
C.S(s) + O2(g) =SO2(g);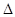 H=-(2a- H=-(2a- )kJ/mol )kJ/mol |
D.S(s) + O2(g) =SO2(g);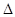 H=-(b-a)kJ/mol H=-(b-a)kJ/mol |

| ||
| ||
| ||
| ||
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com