
题目列表(包括答案和解析)
一定条件下,可逆反应N2 + 3H2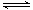 2NH3达到化学平衡状态,下列说法一定正确的是( )
2NH3达到化学平衡状态,下列说法一定正确的是( )
| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的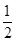 |
一定条件下,可逆反应N2 + 3H2 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是
| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的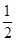 |
 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是| A.每1 mol N≡N断裂的同时有2 mol N—H生成 |
| B.N2、H2、NH3的浓度之比为1:3:2 |
| C.N2减少的速率和NH3减少的速率之比为1:2 |
D.气体体积为初始体积的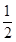 |
一定条件下,可逆反应N2 + 3H2![]() 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是
A.每1 mol N≡N断裂的同时有2 mol N—H生成
B.N2、H2、NH3的浓度之比为1:3:2
C.N2减少的速率和NH3减少的速率之比为1:2
D.气体体积为初始体积的1/2
 2NH3是工业上合成氨的重要反应.
2NH3是工业上合成氨的重要反应.
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com