
题目列表(包括答案和解析)
(2)室温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1 mol·L
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2


下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,![]() 。
。
若加入少量醋酸钠固体,则CH3COOH![]() CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+![]() O2(g)
O2(g)![]() CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g)![]() CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g)![]() 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,。若加入少量醋酸钠固体,则CH3COOH
CH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+1/2O2(g)CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g)CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g)2Fe2O3(s),△H=-1641.0 kJ/mol
下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,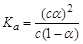 。若加入少量醋酸钠固体,则CH3COOH
。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+1/2O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com