
题目列表(包括答案和解析)
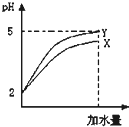 常温下pH均为2的两种酸溶液X和Y各10mL分别加水稀释到10000mL,其pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温下pH均为2的两种酸溶液X和Y各10mL分别加水稀释到10000mL,其pH与所加水的体积变化如图所示,下列结论中正确的是( )| +4 |
| Xe |
| +6 |
| Xe |
| +6 |
| Xe |
| c(H+)×c(F-) |
| c(HF) |
 Cu2++2OH-,Ksp=c(Cu2+)?[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
Cu2++2OH-,Ksp=c(Cu2+)?[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.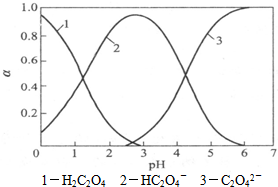 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
| ||
| ||
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com