
题目列表(包括答案和解析)

试根据推断回答下列问题:
(1)写出A、B反应生成C的离子方程式:__________________________________。
(2)写出由H生成I的化学方程式:__________________________________。
(3)A、C、E、G氧化性由强到弱的顺序为。(用相应物质的化学式表示)
(4)E的溶液可以作净水剂,用离子方程式和必要的文字解释其净水原理:_____________。
(5)K物质可能为(至少写两种)__________________________________。
(6)某同学设计了一种电解法制取H的实验装置(如下图所示)。通电后,溶液中产生大量的H,且较长时间不被氧化。

下列说法中正确的是___________________________________________________。
A.阴、阳两极的材料必须相同
B.可以用NaOH溶液作为电解液
C.可以用NaCl溶液作为电解液
D.a一定为正极,b一定为负极
E.阴极发生的反应是:2H++2e-![]() H2↑
H2↑

(1)电源:a是________极,C池是________池。A池阴、阳极电极反应:__________,C池阴、阳极电极反应:________。
(2)如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
(3)如果A池溶液也是200 mL(电解过程溶液体积不变),则通电后,溶液的pH为________。
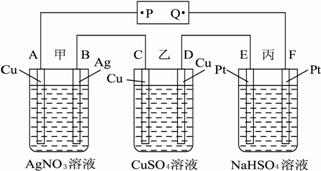
A.P是电源的正极
B.F极上发生的反应为:4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
C.通电后,甲、乙、丙三池中,除了E、F两极外,其他电极均参加了反应
D.通电后,甲池溶液的pH减小,而乙、丙两池溶液的pH不变
甲醇(
CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知CH3OH(1)+O2(g)=CO(g)+2H2O(g);ΔHa=-443.64 kJ·mol-1
2CO(g)+O2(g)=2CO2(g);ΔHb=-566.0 kJ·mol-1
(
1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:________
(
2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量.试利用(1)中的热化学方程式计算,完全燃烧20 g甲醇,生成二氧化碳和水蒸汽时,放出的热量为________kJ,生成的CO2气体标准状况下体积是________L.(
3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:甲醇在
________极反应;电极反应式为________.(
4)利用电池可实现电能向化学能转化.某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.
下列说法中正确的是
________(填序号)A.
电源中的a一定为正极,b一定为负极B.
可以用NaCl溶液作为电解液C.A
、B两端都必须用铁作电极D.
阴极发生的反应是:2H++2e-→H2↑若将所得
Fe(OH)2沉淀暴露在空气中,其颜色变化是________,反应的化学方程式为________.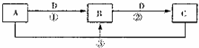
| ||
| ||
| ||
| △ |
| ||
| △ |
 Ⅰ
Ⅰ湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com