
题目列表(包括答案和解析)
某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%,它们燃烧的热化学方程式分别为
C3H8(g)+5O2(g)→3CO2(g)+4H2O(g) △H=–2200KJ·mol-1
2C4H10(g)+13O2(g)→8CO2(g) +10H2O(g) △H=–5800KJ·mol-1
有一质量为0.8Kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056Kg。试计算该燃料的利用率[已知水的比热为4.2KJ/(Kg·℃),铝的比热为0.88KJ/(Kg·℃)]
某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%,它们燃烧的热化学方程式分别为
C3H8(g)+5O2(g)→3CO2(g)+4H2O(g) △H=2200KJ?mol-1
2C4H10(g)+13O2(g)→8CO2(g)+10H2O(g) △H=5800KJ?mol-1
有一质量为0.8Kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056Kg。试计算该燃料的利用率[已知水的比热为4.2KJ/(Kg?℃),铝的比热为0.88KJ/(Kg?℃) ]
某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%.它们燃烧的热化学方程式分别为:
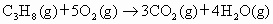 ;
;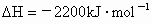
 ;
;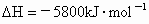
有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056kg.试计算该燃料的利用率.已知水的比热为 ,铝的比热为
,铝的比热为 .
.
(1)它们燃烧的热化学方程式分别为:________,________。
(2)有一质量为0.80kg,容积为4.0L的铝壶,将一壶20℃的水烧开需消耗石油液化气多少千克?[假设热量利用率为60%,水的比热为4.2kJ/(kg×℃),铝的比热为0.88kJ/(Kg×℃)]。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com