
题目列表(包括答案和解析)
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
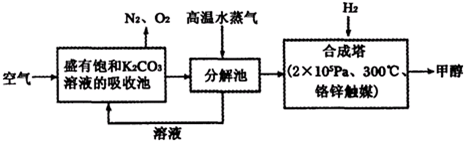
 Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g)
Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g) 2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题: 2SO3(g).根据下列要求填写空白:
2SO3(g).根据下列要求填写空白:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生以下的反应:
N2(g)+3 H2(g)  2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1 mol ,c=2 mol ,则b=____ mol,在此情况下,反应起始时将向 方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是 。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施 是
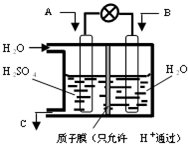
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g) 2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 H++HCO3ˉ 的电离平衡常数 ;
H++HCO3ˉ 的电离平衡常数 ; H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .
H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com