
题目列表(包括答案和解析)
|
在蒸发皿中加热蒸干下列溶液后再充分灼烧(低于400℃),可得该物质固体的是 | |
| [ ] | |
A. |
氯化铝 |
B. |
小苏打 |
C. |
硫酸镁 |
D. |
亚硫酸钠 |
| A、配制一定物质的量浓度溶液,容量瓶未经干燥,不影响浓度的大小 | B、不可直接加热蒸发皿,要垫石棉网 | C、配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 | D、实验室制取CO2气体时,既可用排水法收集又可用排空气法收集 | E、在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 | F、观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察焰色为紫色 |
四种盐在不同温度下的溶解度(g/100 g水)表
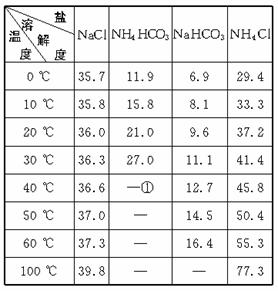
①>35 ℃ NH4HCO3会有分解
请完成下列问题:
(1)反应温度控制在30 ℃—35 ℃,是因为若高于35 ℃,则_______________________,若低于30 ℃,则______________________________________;为控制此温度范围,采取的加热方法为___________________________________。
(2)加料完毕后,继续保温30分钟,目的是________________________________ 。静置后只析出NaHCO3晶体的原因是_____________________________。用蒸馏水洗涤NaHCO3晶体的目的是除去________________________________杂质(以化学式表示)。
(3)过滤所得的母液中含有_______________________(以化学式表示),需加入______________________,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)= __________________。
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com