
题目列表(包括答案和解析)

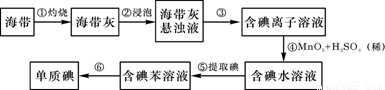
(15分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化H2O2
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(15分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
此步操作还可以加入更合适的试剂是_________(从下面选择填代号);理由是___
____________________________________________________________________。
A、浓硫酸 B、新制氯水 C、酸化H2O2
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(10分)Ⅰ中国有广阔的海岸线,海水的综合利用大有可为,海水中溴含量约为65mg/L,从海水中提取Br2的工艺流程如下:
(1) 步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 ;
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2) 请写出步骤Ⅱ中反应的离子反应方程式 ;
(3) 实验室分离溴水中的溴还可以用萃取法,下列可以用作萃取剂的是 ;
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
Ⅱ (1)目前世界上60%的镁单质是从海水中提取的。以下是海水中提炼金属镁的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)
(2)海带中含有碘离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com