
题目列表(包括答案和解析)
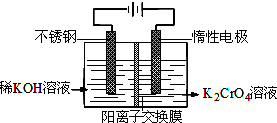
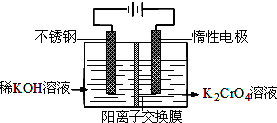
| A.在阴极区,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | ||||
B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2Cr
| ||||
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
| ||||
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=
|
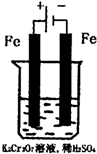 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
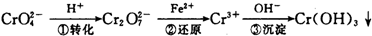
2- 4 |
2- 7 |
2- 3 |
2- 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com