
题目列表(包括答案和解析)
 溶液和CH3COONa溶液,
溶液和CH3COONa溶液,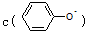 <c(CH3COO-)
<c(CH3COO-) 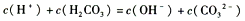
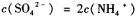
 2PbSO4+2H2O
2PbSO4+2H2O| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | ______ | ______ |
| ②铅离子浓度减小对平衡的影响 | ______ | ______ |
| ③______ | 在PbI2悬浊液中加入少量FeCl3饱和溶液 | ______ |
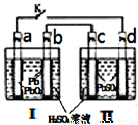

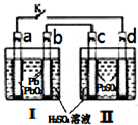 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
| ||
| 充电 |
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, |
溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp 溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 |
黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp 黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp |
| ③ 铅离子和碘离子浓度都减小对平衡的影响 铅离子和碘离子浓度都减小对平衡的影响 |
在PbI2悬浊液中加入少量FeCl3饱和溶液 | PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
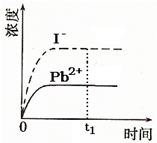 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com