
题目列表(包括答案和解析)
【6分】已知A、B、C、D为气体,E、F为固体,G为氯化钙,它们之间的转换关系如下图所示:

(1)D的化学式(分子式)是_____________,E的化学式(分子式)是_____________。
(2)A和B反应生成C的化学方程式是_________________________________________。
(3)E和F反应生成D、H和G的化学方程式是_________________________________。
(共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图。请回答:
(1)写出B的电子排布图 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是 ;
(2)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 :
(3)写出C的单质与水反应的化学方程式 ;
(4)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
(1)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下 :
: aA (g)+ bB (g)
aA (g)+ bB (g)  2C(g)
2C(g)  起始物质的量(mol): 3 2 0
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a= ,b= ;
②2S内B的反应速率= 。
(2)(4分)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有 个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)(2分)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示)。
(10分)计算填空:
(1)(2分)1mol某金属单质与足量的H2SO4反应,放出1.5molH2(标况下)并转化为具有Ne原子的电子层结构的离子,则该金属在周期表的位置 。
(2)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
_ aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a= ,b= ;
②2S内B的反应速率= 。
(3)(2分) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。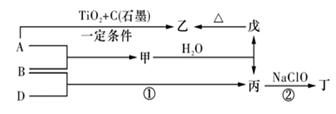
请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com