
题目列表(包括答案和解析)
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
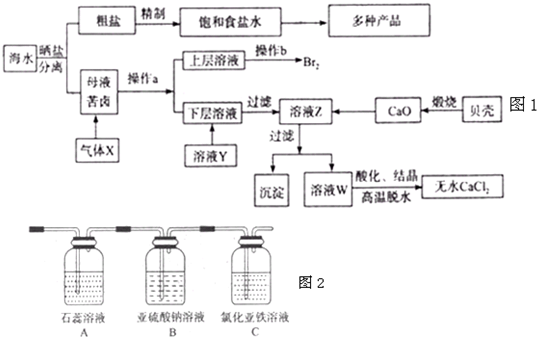
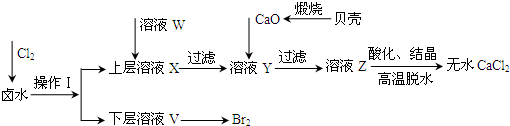
(共12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2按1:1正好完全反应,则反应方程式为 。
(2)上述反应中的还原剂是 ,为了防止大气污染,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10 NO-3 = 2H3AsO4+3S↓+10NO2↑+ 2H2O
若生成1mol NO2 ,则反应中转移的电子数为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.等于0.5mol b.小于0.5 mol c.大于0.5mol d.无法确定
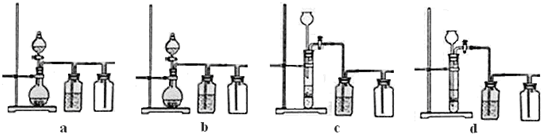
12分)已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数值是 。若
A(g)+B(g)的平衡常数值是 。若湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com