
题目列表(包括答案和解析)
(1)X与Na+组成的离子化合物常温下跟水反应产生一种可助燃的气体,该反应的化学方程式为_____________________________。
(2)若Y为遇水就剧烈反应的单质,则Y的电子式为______________;若Y为化合物,用石墨作电极电解Y的水溶液,其电解总反应式为_____________________________。
(3)在淀粉KI溶液中滴加Z的水溶液,溶液变蓝,其原因可用离子方程式表示为_____________________________。
(4)在最初载人飞船的火箭推进器中,一般采用Z和W两种液态化合物,当它们混合反应时生成氮气和一种常见液态氧化物。已知
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:(10分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为____________________________________________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。
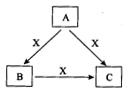
请针对以下不同情况回答:
(1)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e![]() 结构。
结构。
①下列有关B物质的叙述正确的是
a、B的分子式为AX b、B为共价化合物
c、B分子呈三角锥形 d、B性质稳定,不与除X外的任何物质发生化学反应
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 。
(15分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见非金属元素,将A、C的水
溶液混合可得B的沉淀
①A、B、C中含有的同一种常见非金属元素为___________。
②写出A、C的水溶液混合生成沉淀B的化学反应方程式
为 。
(2)若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e![]() 结构。
结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_____________![]() 。
。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是_____________。
②将过量X通入100mL 3 mol/L A的水溶液中,将所得溶液与明矾溶液混合,写出混合时反应的离子方程式___________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com