工业上“固定”和利用CO
2能有效地减轻“温室效应”.
(1)目前工业上利用CO
2来生产燃料甲醇,可将CO
2变废为宝.已知常温常压下:
①CH
3OH(l)+O
2(g)═CO(g)+2H
2O(g)△H=-354.8kJ/mol
②2CO(g)+O
2(g)═2CO
2(g)△H=-566kJ/mol
则反应2CO
2(g)+4H
2O(g)═2CH
3OH(l)+3O
2(g)△H=______kJ?mol
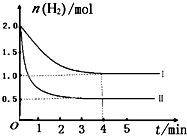
-1(2)T℃时,已知反应:CO
2(g)+H
2(g)?CO(g)+H
2O(g)△H<0.在T℃下,将2mol CO
2和2mol H
2充入1L的密闭容器中,测得H
2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H
2)=______.
②在T℃时,若仅改变某一外界条件时,测得H
2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为______.计算该反应按曲线II进行,达到平衡时,容器中c(CO
2)=______.
(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
①用饱和氨水吸收CO
2可得到NH
4HCO
3溶液.若已知CH
3COONH
4溶液pH=7,则 NH
4HCO
3溶液显______(填“酸性”、“碱性”或“中性”).
②在25℃时,在乙酸溶液中加入一定量的NaHCO
3,保持温度不变,所得混合液的pH=6,那么混合液中
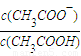
=______.
③向0.1mol?L
-1CH
3COOH溶液中加入少量CH
3COONa晶体,保持温度不变,下列有关说法正确的是______(填代号).
a.溶液的pH增大 b.CH
3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH
-)?c(H
+)不变.


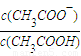 =______.
=______.
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.