
题目列表(包括答案和解析)
(2)由于错误操作,使得到的数据比正确数据偏大的是___________。
A.用量筒量取一定量液体时,仰视液面读数
B.使用容量瓶配制溶液时,仰视液面进行定容,所得溶液的浓度
C.中和滴定达到终点时,仰视滴定管液面的读数
(3)有下列实验:①氯气的制取 ②乙烯的制取 ③石油的分馏 ④乙酸乙酯的制取,其中不需要温度计的有___________(填写编号)。
(4)下列实验中选用的仪器或操作以及结论合理的是___________。
A.用碱式滴定管量取25.00mL酸性KMnO4溶液
B.测定溶液的pH时,用玻棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡进行比色
C.pH相等的NaOH和氨水,只用pH试纸和蒸馏水就可以鉴别
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。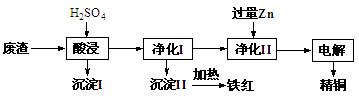
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO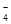 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com