
题目列表(包括答案和解析)
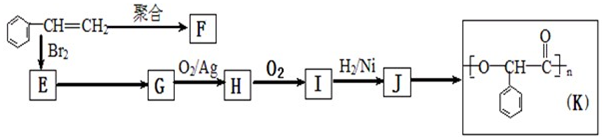


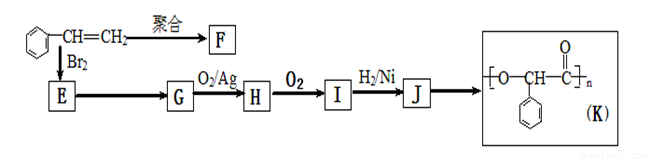
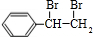 +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr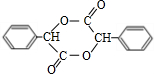

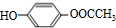

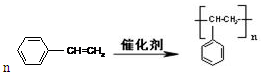
由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料。
(1)J中所含官能团的名称为 ;K中所含官能团的结构简式为
(2)聚合物F的结构简式是 ;I的分子式是 。
(3)E转化为G的化学方程式是 ;反应类型属于
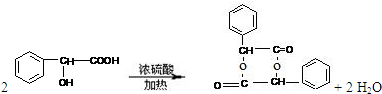
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式 。
(5)写出J 的一种符合下列条件的同分异构体X结简式 。
①1mol X可以与3mol NaOH反应 ②X分子中氢原子核磁共振氢谱有4个峰,


| 500-850℃ |
| 雾化后废硫酸液滴直径 | 废硫酸完全裂解所需时间 | |
| 普通雾化器 | 800-1200/μm | 10s以上 |
| 旋转式雾化器 | 600-850 μm | 8-10s |
| 压缩风雾化器 | 400-650 μm | 6-7s |
| 超声波雾化器 | 100-300μm | 3.5-5s |


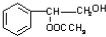 或
或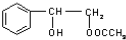
 或
或

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com