
题目列表(包括答案和解析)
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是 (填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是 (填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。

①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是 (填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
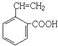
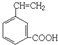
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于 (填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为 。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是 (填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生 腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有 性。
② (填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是 (填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入 (填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是 (填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是 。
| ||
| (ii)H2O2/OH- |
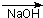
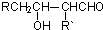

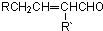
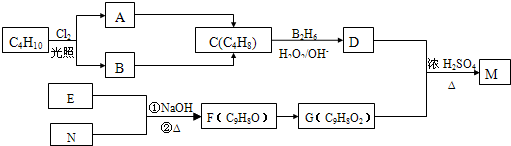
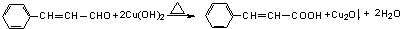
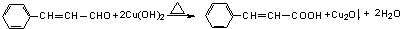
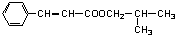
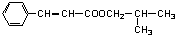
 、
、 、
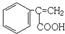
、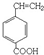 、
、
 、
、 、
、 、
、
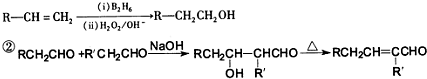
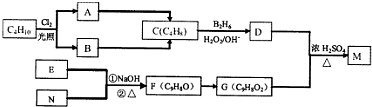
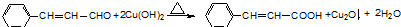
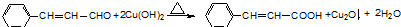
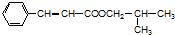
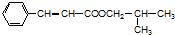
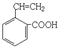 或
或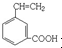 或
或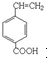 或
或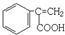
 或
或 或
或 或
或
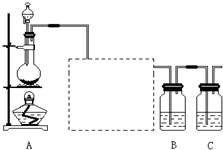 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。

A.离子键 B.共价键 C.配位键 D.氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com