
题目列表(包括答案和解析)
下列说法不正确的是
A.除去N2中的少量O2:通过灼热的Cu粉,收集气体
B.铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4
C.用盐酸酸化KMnO4溶液可以增强其氧化性
D.强电解质在水中溶解度不一定大于弱电解质在水中的溶解度
下列说法正确的是( )
A.碳酸钙难溶于水,放入水中不导电,且碳酸钙960℃时分解不存在熔融状态导电的性质,故碳酸钙是非电解质
B.SO2溶于水后得到的水溶液能导电,所以它是电解质
C.NaHSO4的电离方程式是:NaHSO4 ![]() Na++H++ SO42-
Na++H++ SO42-
D.NH3·H2O是虽然极易溶于水,但在水中是部分电离的,所以它是弱电解质

工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
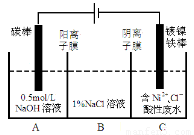
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com