
题目列表(包括答案和解析)
|
在20℃时,将10 g摩尔质量为M(A)(g/mol)的A物质投入90 g水中,刚好完全溶解,形成的溶液为饱和溶液(假设溶液的密度为1 g/mL),则下列说法中正确的是 | |
| [ ] | |
A. |
20℃时,A的溶解度一定是100/9 g |
B. |
20℃时,A的溶解度可能是10 g |
C. |
形成的饱和溶液的溶质质量分数一定为10% |
D. |
形成的饱和溶液的物质的量浓度一定为100/M(A)mol/L |
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)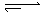 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(A) |
0.20 |
0.14 |
b |
0.09 |
0.09 |
0.09 |
|
c(B) |
0.00 |
0.12 |
0.20 |
c |
d |
e |
(1)m= ,表中b c(填“<”、“=”或“>”)。
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度____________0.09 mol/L(填“<”、“=”或“>”)。
(3)在80℃时该反应的平衡常数K值为 (保留1位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②A与B的浓度之比越大
③B的产量越大 ④正反应进行的程度越大
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(A) |
0.20 |
0.14 |
0.10 |
c |
d |
e |
|
c(B) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
⑴m= ,表中b c(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为 (保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②B的产量越大
③A与B的浓度之比越大 ④正反应进行的程度越大
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:
A(g)![]() mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | 0.10 | c | d | e |
| c(B) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
⑴m= ,表中b c(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为 (保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②B的产量越大
③A与B的浓度之比越大 ④正反应进行的程度越大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com