
题目列表(包括答案和解析)
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量![]() m(H20),由此计算
m(H20),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:[来源:学§科§网Z§X§X§K]
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大![]() 的是_______________ (填序号);
的是_______________ (填序号);
![]() Cu0未完全起反应 ② CuO不
Cu0未完全起反应 ② CuO不![]() 干燥
干燥
![]() Cu0中混有不反应的杂质 ④ 碱石灰不干燥
Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________![]() _____和_______________达到实验目的。
_____和_______________达到实验目的。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第Ⅰ题为选择题,在给出的四个选项中,至少有两项是符合
题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,
请在答题卡相应位置做答并写明小题号。

粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: 、
、 、
、 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
|
|
|
|
开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
|
完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
|
|
第一次实验 |
第二次实验 |
|
坩埚质量(g) |
14.520 |
14.670 |
|
坩埚质量 |
17.020 |
18.350 |
|
第一次加热、冷却、称量(g) |
16.070 |
16.989 |
|
第二次加热、冷却、称量(g) |
16.070 |
16.988 |
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚

Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(Ⅰ)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.
(1)在(Ⅰ)中,刚通人CO2时发生的反应化学方程式为________;而后又发生反应的离子方程式为________.
在(Ⅱ)中煮沸溶液的目的是________.
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是________.
(2)按该同学的设计,第(I)步实验装置如下:
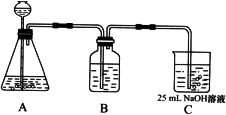
①装置A使用的试剂是________(固体)和________溶液;
②装置B使用的试剂最好是________(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是________,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com