
题目列表(包括答案和解析)
(本题共8分)
已知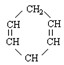 可简写为
可简写为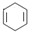 。现有某化合物W的分子结构可表示为
。现有某化合物W的分子结构可表示为 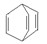 。根据题意回答:
。根据题意回答:
1.W属于
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
2.W的分子式为 ,它的一氯代物有 种。
3.有关W的说法错误的是
A.能发生还原反应 B.能发生氧化反应
C.易溶于水 D.等质量的W与苯分别完全燃烧,前者消耗的氧气多
4.W有一种芳香族的同分异构体,该物质能在一定条件下发生聚合反应,相应的化学方程式为 。
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)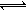 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O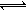 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―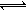 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)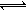 Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH―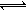 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(每空2分,共8分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种 ,并且互不重复:NH
,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO 、NO
、NO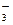 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是______,判断理由是___________________________________________________________________________。
(2)写出B物质的化学式_____。
(3)写出D和B反应的离子方程式___________________。
(8分)已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引。
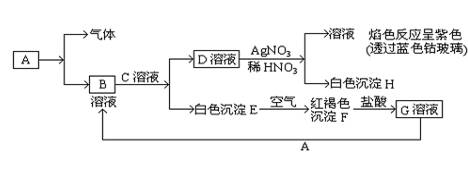
(1)试回答: 写出B的化学式 H的化学式 。
⑵ 写出由E转变成F的化学方程式 。
⑶向G溶液加入A的有关离子反应方程式 ____。
(8分)
I已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
(1)氢气的燃烧热△H= kJ/mol
(2)燃烧2gH2生成水蒸气,放出的热量为 kJ。
Ⅱ把煤作为燃料可通过下列两种途径获得热量:
途径1:直接燃烧
C(s)+O2(g)=CO2(g) △H=E1 ①
途径2:先制成水煤气,再燃烧水煤气
C(s)+H2O(g)=CO(g)+H2(g) △H=E2 ②
H2(g)+1/2 O2(g)=H2O(g) △H=E3 ③
CO(g)+1/2 O2(g)=CO2(g) △H=E4 ④
请回答:
(1)上述四个热化学方程式中哪个反应△H >0? (填序号)
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
(填选项字母)。
A.途径1比途径2多 B.途径1比途径2少 C.途径1与途径2在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com