
题目列表(包括答案和解析)
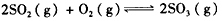 反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为l mol SO3(g)的△H= -99 kJ/mol
反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为l mol SO3(g)的△H= -99 kJ/mol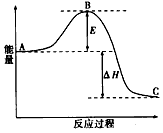
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
化学反应中存在着能量的变化。
(1)在25 ℃、101 kPa时,1 mol CO(g)与0.5 mol O2(g)充分反应生成1 mol CO2(g),放出283.0 kJ的热量,该反应的热化学方程式为 ;
(2)某次发射卫星火箭用N2H4(肼)作燃料, NO2作助燃剂,反应生成N2和液态H2O。资料显示:N2(g) +2O2(g) =2NO2(g) △H=+67.2kJ/mol ①
N2H4(g)+O2(g) = N2(g) +2H2O(g) △H=-534kJ/mol ②
写出肼与NO2反应的热化学方程式 。
化学反应原理:
(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
![]() (4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热,等等.
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________.(填ΔH1、ΔH2 和ΔH3等)
A.2H2(g)+O2(g)=2H2O(l) ΔH1;
B.C(s)+1/2O2(g)=CO(g) ΔH2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3;
D.C(s)+O2(g)=CO2(g) ΔH4;
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l); ΔH7
(2)2.00gC2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量.写出该反应的热化学方程式: 。
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5 mol/L100mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X) 。
(4)碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径。甲烷是一种重要的清洁燃料,燃烧放出大量的热,可直接作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol
则表示甲烷燃烧热的热化学方程式 ;
请从化学反应的本质解释甲烷燃烧放出热量的原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com