
题目列表(包括答案和解析)
(共16分)
(1)现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比  将________。
将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:

在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
(共16分)
(1)现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比 将________。
将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;② 增大压强____________; ③增大容器容积____________;
④ 加入A____________; ⑤ 加入B____________; ⑥ 加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g)
△H1=+156.6
kJ·mol-1
CH(g)+H2(g)
△H1=+156.6
kJ·mol-1
CH3CH CH2(g)=
CH4(g)+HC
CH2(g)=
CH4(g)+HC CH(g
) △H2=+32.4
kJ·mol-1
CH(g
) △H2=+32.4
kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g)
的△H=
kJ·mol-1。
CH2(g)+H2(g)
的△H=
kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
|
化学键 |
C—H |
C—F |
H—F |
F—F |
|
键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H=______________________
(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________; ⑤加入B____________; ⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g ) △H2="+32.4" kJ·mol-1
CH(g ) △H2="+32.4" kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
 -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: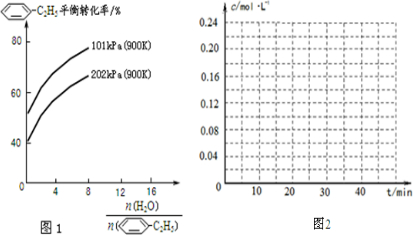
| 时间/min | 0 | 10 | 20 | 30 | 40 |
n( -C2H5)/mol -C2H5)/mol |
0.40 | 0.30 | 0.26 | n2 | n3 |
n( -CH=CH2)/mol -CH=CH2)/mol |
0.00 | 0.10 | n1 | 0.16 | 0.16 |
 -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线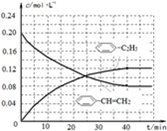

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com