
题目列表(包括答案和解析)
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下: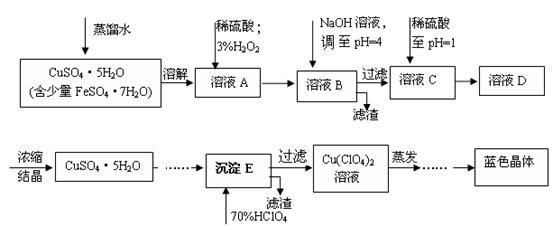
已知:
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:

已知:
|
离子 |
溶液pH值 |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下试验:
(1)取样品 ag ,称取时使用的仪器名称为 。
(2)将样品溶于足量的稀盐酸中,过滤,滤渣中含有 ,在溶解过滤时使用的玻璃仪
器有 。
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式 。
(4)在第( 3 )步的滤液中通入足量CO2,过滤。有关反应的离子方程式是 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至质量不再减轻为止,冷却后称量,质量为bg,则原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏 (填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏 ;若滤渣燃烧不充分,则实验结果偏 。
.(12分)某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,某同学设计如下试验:
(1)取样品 ag ,称取时使用的仪器名称为 。
(2)将样品溶于足量的稀盐酸中,过滤,滤渣中含有 ,在溶解过滤时使用的玻璃仪
器有 。
(3)往滤液中加入过量的NaOH溶液、过滤,写出该步操作中有关的离子方程式 。
(4)在第( 3 )步的滤液中通入足量CO2,过滤。有关反应的离子方程式是 。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次后,烘干并灼烧至质量不再减轻为止,冷却后称量,质量为bg,则原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果偏 (填“高”、“低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果偏 ;若滤渣燃烧不充分,则实验结果偏 。
( 14分)为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)
。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体 Y中SO2的含量,设计如下三种方案:
Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是 ,理由是 。
②选择合理方案的数据计算气体Y中SO2的体积分数
(用含未知数的代数式表示) 。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。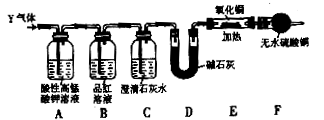
(3)装置A中试剂的作用是 。
(4)简述确认气体Y中含有CO2的实验现象: 。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠? (填“可靠”或“不可靠”),简述理由:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com