
题目列表(包括答案和解析)
(5分)钛(Ti )被称
为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
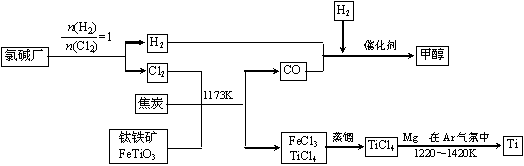
在上述产业链中,合成96 t甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失,要写出计算过程)。
选做题(本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分)

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
1.《有机化学基础》
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应:

请回答下列问题:
(1)G→H的反应类型是_______________。
(2)M的结构简式为_______________;C的结构简式为_______________。
(3)写出下列反应的化学方程式:
①A→B的化学方程式:________________________________________________________;
②H→I的化学方程式:_________________________________________________________。
2.《物质结构与性质》Ⅰ.图表法、图像法是常用的科学研究方法。


图A 图B
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第_____族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_____族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是_____(填“a”或“b”)。
Ⅱ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(3)Ti元素的基态原子的价电子层排布式为____________。
(4)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是__________;晶体内与每个“Ti”紧邻的氧原子数为_________个。

(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。则绿色晶体配合物的化学式为_______________。
。则绿色晶体配合物的化学式为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com