
题目列表(包括答案和解析)
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
该反应的反应方程式可表示为 ,平衡时Y气体的转化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
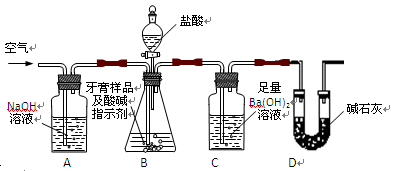
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 | | ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ | |
(本小题满分16分)
Ⅰ.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有 (多选扣分)
a. 开发氢能源 b. 使用电动车 c. 植树造林 d.戴上呼吸面具
Ⅱ.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,
D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
(1) 指出元素A在周期表中的位置 ,其气态氢化物的化学式为 。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号) ,
可以验证该结论的是(填写字母序号) ;
A.比较这两种元素的常见单质的熔沸点 B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序: 。(填写化学式)
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
|
实验步骤 |
实现现象 |
反应的离子方程式 |
|
往滤渣中加入过量NaOH溶液。 |
|
① |
|
过滤,往所得滤液中通入过量二氧化碳, |
② |
③ |
|
继续加入过量稀盐酸 |
④ |
|
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
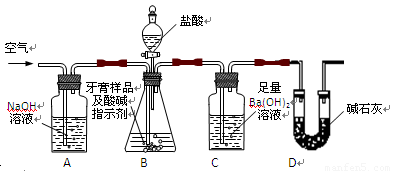
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
(16 分)某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【查阅资料】:草酸铵![]() 属于弱电解质:草酸钙
属于弱电解质:草酸钙![]() 难溶于水;
难溶于水;![]() 、
、![]() 、
、![]() 完全沉淀的pH;
完全沉淀的pH;![]() :
:![]() ;
;![]() ;
;![]() 。
。
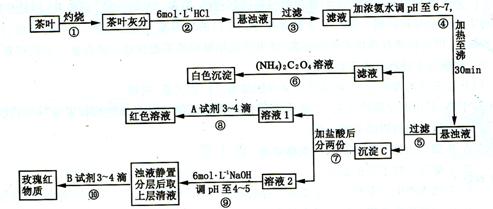
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是__________________________。
(2)写出检验![]() 的离子方程式______________________________。
的离子方程式______________________________。
(3)写出沉淀C所含主要物质的化学式________________________。
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式____________________。
(5)步骤⑨的作用是__________,发生反应的离子方程式____________________。
(6)猜测步骤⑩的目的是____________________________。
(7)已知:![]() ,
,![]() ;
;![]() ;
;![]() ,则
,则![]() _______
_______![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com