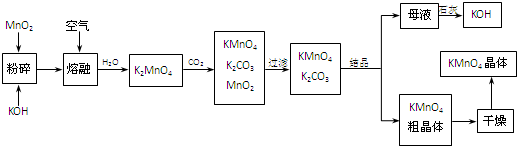
【必考题】
过氧化尿素[CO(NH
2)
2?H
2O
2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H
2O
2):n(CO(NH
2)
2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
.
(2)从母液中分离出H
2O
2和尿素,采用的操作是
c
c
.
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H
2O
234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO
4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO
4溶液20.00mL(KMnO
4溶液与尿素不反应).
①KMnO
4溶液应盛放在
酸
酸
式(选填:“酸”、“碱”)滴定管中.
②完成并配平方程式:
2
2
MnO
4-+
5
5
H
2O
2+
6
6
H
+=
2
2
Mn
2++
8
8
H
2O+
5O2
5O2
③根据滴定结果,可确定产品中活性氧的质量分数为:
13.3%
13.3%
.
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
偏高
偏高
(选填:“偏高”、“偏低”或“不变”).
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
尿素
尿素
.



 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。 的是________。
的是________。