
题目列表(包括答案和解析)
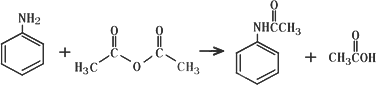
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
实验步骤:
①取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于________;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有________.
A、反应快结束时的充分搅拌
B、旋摇下分批加入6.0 mL乙酸酐
C、玻璃棒将块状物研碎
D、加20 ml水
(2)步骤②洗涤粗产品时,选用的溶剂是________.
A、热水
B、冷水
C、1∶3乙醇溶液
D、滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择________(填“过滤”、“趁热过滤”或“抽滤”);配制热溶液时,加入过量溶剂的作用是________(选出正确选项);;
A、防止后续过程中,溶剂损失可能产生的产物析出
B、防止后续过程中,温度降低可能产生的产物析出
C、除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时选择在室温下自然冷却,若选择在冰水浴中冷却会使得到的沉淀颗粒太小,则进行抽滤操作时会________;
(5)步骤③中以下哪些操作不能提高产率________.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体
A、①④⑤
B、①④
C、④⑤
D、②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75 g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93 g/mol、102 g/mol、135 g/mol.该实验的产率为________(保留两位有效数字)
(16分)I、关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知 。(填序号)
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
④在该反应中,氧化剂与还原剂的物质的量之比为 。
Ⅱ、X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应:![]() +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
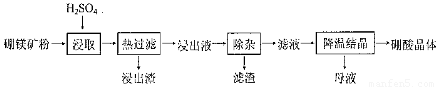
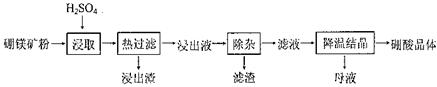
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
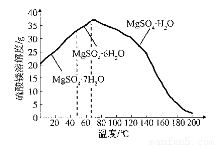
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
 [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)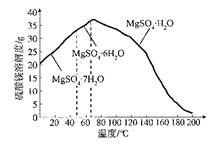
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com