
题目列表(包括答案和解析)
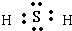
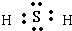
(14分)A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ▲ 、C ▲ 、E ▲ 、F ▲ 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ▲ ,甲为 ▲ (填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙 ▲ ;常温下甲为液态,乙为气态,试解释原因 ▲ 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
▲ 。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 ▲ 。
⑹写出元素F的外围电子排布式 ▲ 。
(14分)A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ▲ 、C ▲ 、E ▲ 、F ▲ 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ▲ ,甲为 ▲ (填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙 ▲ ;常温下甲为液态,乙为气态,试解释原因 ▲ 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
▲ 。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 ▲ 。
⑹写出元素F的外围电子排布式 ▲ 。
(14分)A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ▲ 、C ▲ 、E ▲ 、F ▲ 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ▲ ,甲为 ▲ (填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙 ▲ ;常温下甲为液态,乙为气态,试解释原因 ▲ 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
▲ 。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 ▲ 。
⑹写出元素F的外围电子排布式 ▲ 。
A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子。
请回答下列问题:
⑴写出下列元素的元素符号:A ▲ 、C ▲ 、E ▲ 、F ▲ 。
⑵元素A和元素B可以形成A2B物质甲,写出甲的分子式 ▲ ,甲为 ▲ (填“极性”或“非极性”)分子。
⑶元素A和元素E形成化合物乙,用电子式表示化合物乙 ▲ ;常温下甲为液态,乙为气态,试解释原因 ▲ 。
⑷元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:
▲ 。
⑸元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是 ▲ 。
⑹写出元素F的外围电子排布式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com