(2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO
3溶液400mL,加热,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
50 |
70 |
| pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
(1)甲同学认为,该溶液的pH升高的原因是HCO
3-的水解程度增大,故碱性增强,该反应的离子方程式为
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
;
(2)乙同学认为,溶液pH升高的原因是NaHCO
3受热分解,生成了Na
2CO
3,并推断Na
2CO
3的水解程度
大于
大于
(填“大于”或“小于”)NaHCO
3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH
=
=
8.3(填“>”、“<”或“=”),说明甲正确,若pH
>
>
8.3(填“>”、“<”或“=”),说明乙正确;
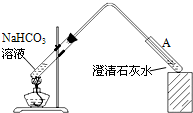
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO
3溶液,发现试管A中产生沉淀,说明
乙
乙
(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO
3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断
乙
乙
(填“甲”或“乙”)推测正确,原因是
溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
溶液冷却至室温后pH大于8.4,说明此实验过程中溶液有新物质生成
.

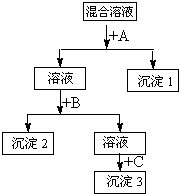 X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:
X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:
 (2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
(2009?佛山一模)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化: