
题目列表(包括答案和解析)


滴定次数 |
盐酸的体积/mL |
NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(12分)某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: ▲ 。
Ⅱ:丙学生用0.100mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(1) 根据以上数据计算出盐酸的物质的量浓度为 ▲ mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。 ▲ 。
某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: ▲ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(12分)某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。

则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。

①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: ▲ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
|
滴定次数 |
盐酸的体积/mL |
NaOH溶液的体积/mL |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
2.00 |
20.20 |
|
2 |
25.00 |
1.02 |
21.03 |
|
3 |
25.00 |
0.20 |
20.20 |
(1) 根据以上数据计算出盐酸的物质的量浓度为 ▲ mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。 ▲ 。
某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。

则X溶液是 ▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
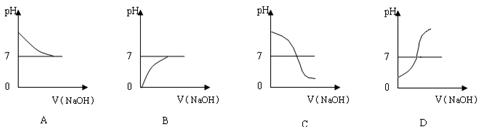
①写出测定溶液pH值的操作方法: ▲ ;
②上图中哪个图像符合该同学的记录 ▲ (填序号)。
(3)你认为甲、乙两位同学的实验中, ▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: ▲ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(1) 根据以上数据计算出盐酸的物质的量浓度为 ▲ mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com