
题目列表(包括答案和解析)
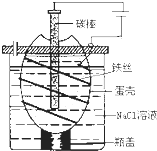 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
| ||
| ||
(1)写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
阳极:______________;阴极:______________。总反应式:______________。
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是______________,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阳极室和阴极室,其作用是______________。
(3)为了使电解氯化钠的速度加快,下列措施可行的是( )
a.增加阴极碳钢网面积 b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离 d.提高电解时的电源电压
(4)如果对某离子交换膜电解槽采取下列措施:①电解时的电压增大到原来的2倍;②电解时电流强度增大到原来的2倍;③电解时的温度从30 ℃提高到60 ℃。则电解速率一定会达到原来的2倍的是______________,解释其原因:_____________________________________
____________________________________________________________________。
(1)写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:?
阳极:_____________________;?
阴极:_____________________;?
总反应式:_____________________。
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是_______,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阳极室和阴极室,其作用是__________________________。
(3)为了使电解氯化钠的速度加快,下列措施可行的是?( )?
a.增加阴极碳钢网面积?
b.提高饱和氯化钠溶液的温度?
c.加大阴极与阳极间的距离?
d.提高电解时的电源电压?
(4)如果对某离子交换膜电解槽采取下列措施:①电解时的电压增大到原来的2倍;②电解时电流增大到原来的2倍;③电解时的温度从30 ℃提高到60 ℃。则电解速率一定会达到原来的2倍的是_______,解释其原因:_____________________。
(9分)工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
(1)写出电解饱和氯化钠溶液时,总离子反应方程式: _____ __。
(2)下列有关说法正确的是
A.电解一段时间后,往蛋壳内溶液中滴加几滴紫色石蕊试液,先变红后又褪色
B.蛋壳表面缠绕铁丝发生氧化反应
C.为增强导电性,可将石墨棒换成铜电极
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
(3)电解200 mL 0.5 mol/L的NaCl溶液,在标准状况下,阴极收集到2.24 L气体时,阳极产生的气体为 L,常温下,若将电解后的溶液稀释至1 L,则溶液的pH约为 ;若将阳极生成的气体通入电解后的溶液中,反应的离子方程式为 ,充分反应后,则所得溶液中阴离子的浓度由大到小依次是__________________。
(4)若将电解后阳极所产生的气体全部通入1 mol/L 500 mLNa2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为________ mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com