
题目列表(包括答案和解析)
|
下列有关活化分子的说法正确的是 | |
| [ ] | |
A. |
增大反应物浓度可以提高活化分子百分数 |
B. |
增大压强一定能提高单位体积内活化分子总数 |
C. |
使用合适的催化剂可以降低活化分子的能量 |
D. |
升高温度一定能提高活化分子百分数 |
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
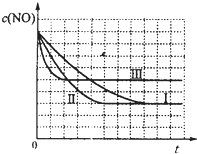
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
 CH3OH
CH3OH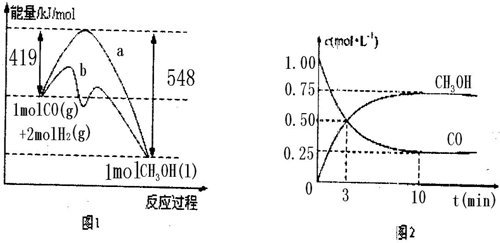
| 3 |
| 2 |
| 3 |
| 2 |
 CH3OH(g)△H<0的平衡常数为
CH3OH(g)△H<0的平衡常数为| 1 |
| 2 |
| 1 |
| 2 |
(10分)甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2 CH3OH
图1表示该反应进行过程中的能量变化:
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:
c(HCOO-)<c(Na+)时,则反应的情况可能为 。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com