
题目列表(包括答案和解析)
(13分)Ⅰ.下列实验操作或实验叙述正确的是______________ (填序号)
①配制氯化铁溶液时,需加少量盐酸;
②用10 mL量筒量取5.80 mL盐酸;
③用稀醋酸除去热水瓶内的水垢[主要成分Mg(OH)2和CaCO3等];
④金属钠着火可用干燥的细沙扑灭;
⑤在酸碱中和滴定实验中,若滴定前锥形瓶未用待测液润洗,则测定结果偏小;
⑥将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡对照以测定该溶液pH。
Ⅱ.某同学为研究硝酸与镁的反应,进行图示实验,实验现象如下:
(a) A中足量某浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色;
(b) 从C进入D中的气体有两种且均为单质;
(c) 将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。
(假设实验前装置中的空气已排尽)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O。
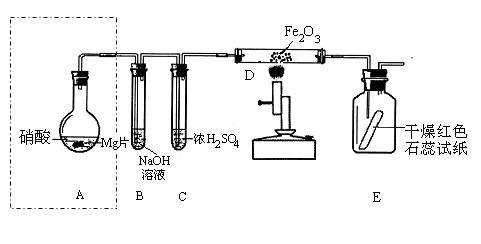
(1)A装置所涉及的实验仪器名称有导管、__________________________ 和 ______________________。
(2)硝酸与Mg片反应生成的气体成分是_________________________(用化学式表示)。
(3)写出D中发生反应的化学方程式①____________________________________;
②________________________________________________________________ 。
下列有关实验的叙述,正确的是________(填字母序号)(有错误选项得0分)
A.配制0.1 mol/L的氯化钠溶液时,将称量的氯化钠固体直接加入容量瓶,再加水至刻度线
B.用洁净且干燥的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上,与标准比色卡对照,测溶液的pH
C.滴定管洗净后,经蒸馏水润洗后注入标准液进行滴定
D.向20 mL煮沸的蒸馏水中滴加FeCl3饱和溶液1~2 mL,继续煮沸1~2分钟,待溶液呈红褐色即得Fe(OH)3胶体
E.用浓氨水洗涤做过银镜反应的试管
F.除去苯中的少量的苯酚,加足量的氢氧化钠溶液,然后分液
G.用水鉴别苯、甘油和硝基苯三种无色液体
H.配制氯化亚铁溶液时,需加少量盐酸及铁粉;
I.用10 mL量筒量取5.80 mL盐酸
J.可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸.
| 滴定次数 | 待测溶液体积/ml | 盐酸标准溶液体积/ml | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5)在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
(13分)图2是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,先后收集20 mL CH4和80 mL Cl2,进行实验。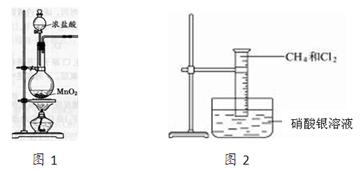
(1)实验室制取氯气的装置如上图1所示,请写出烧瓶中的反应方程式为:
。浓盐酸在反应中体现了
性和 性。
(2)下列常用的干燥剂中,不能干燥氯气的是 。
| A.浓硫酸 | B.P2O5 | C.无水氯化钙 | D.碱石灰 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com