
题目列表(包括答案和解析)
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如右图所示(部分产物略去)。
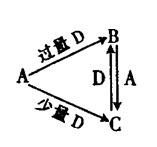
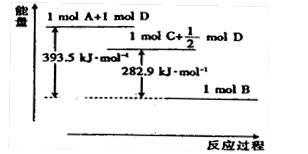
若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如下图,请写出反应![]() 的热化学方程式:
的热化学方程式:
______________________________________________________。
(2)若A为金属单质,D是某强酸的溶液,则反应![]() 的
的
离子方程式是____________________________。
(3)若A、B为盐,D是强碱,A的水溶液显酸性,B的水溶液显碱性。
①C的化学式为________________。
②反应![]() 的离子方程式为________________________________。
的离子方程式为________________________________。
(4)若A为强碱,D为气态氧化物。常温时将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图 b所示(不考虑D的溶解和水
的挥发)。
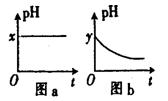
①若图a符合事实,则D为__________(填化学式),此图a中x______7(填“>”“<”或“=”)。
②若图b符合事实,则其pH变化的原因是___________________________
(用离子方程式表示);已知图b中y<7,B的焰色反应为黄色,则B溶液中各离子的浓度由大到小的顺序是_____________________________________。
A、B、C、D均为中学化学中常见的单质或化合物,它们
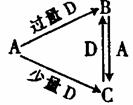
之间的关系如右图所示(部分产物略去)。
(1) 若A为非金属单质,D是空气的主要成分之一。它们之间转化
时能量变化如下图,请写出反应![]() 的热化学方程式:
的热化学方程式:
______________________________________________________。


(2)若A为金属单质,D是某强酸的溶液,则反应![]() 的
的
离子方程式是___________________________________________。
(3)若A、B为盐,D是强碱,A的水溶液显酸性,B的水溶液显碱性。
①C的化学式为________________。
②反应![]() 的离子方程式为________________________________。
的离子方程式为________________________________。
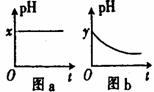
(4)若A为强碱,D为气态氧化物。常温时将B的水溶液露置于空气中,
其pH随时间t变化可能如图a或图 b所示(不考虑D的溶解和水
的挥发)。
①若图a符合事实,则D为__________(填化学式),此图a中
x______7(填“>”“<”或“=”)。
②若图b符合事实,则其pH变化的原因是___________________________
(用离子方程式表示);已知图b中y<7,B的焰色反应为黄色,则B溶液中各离子的浓度由大到小的顺序是_____________________________________。
 2NH3(g)
2NH3(g)| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+



A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为___________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是___________________________________。
(5)已知:2CD2(g) ![]() C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
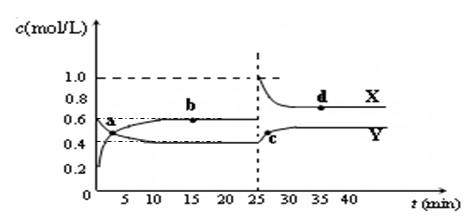
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com