
题目列表(包括答案和解析)
(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:
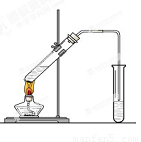
(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
(12分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 _________ ,K值大小与温度的关系是:温度升高,K值_____________ 。(填一定增大、一定减小、或可能增大也可能减小)。
(2) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
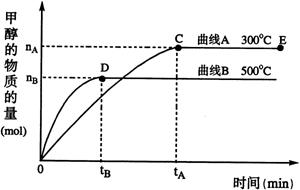
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
③据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
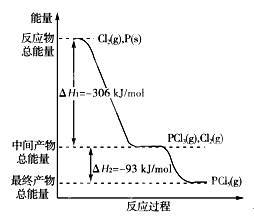
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________________
________________________________________________________________________
____________________________________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________________________。
(每空2分共计12分)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如 图所示。
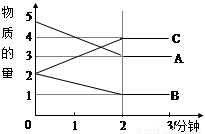
①则该反应的的反应物是 ,生成物是 ,
②化学方程式为 ;
③反应开始至2分钟时,能否用C表示反应速率?
④若能,其反应速率为 ,若不能,则其原因为 ;
⑤2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
(12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为 ▲ (填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
|
烧杯编号 |
① |
② |
③ |
|
加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
|
红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
⑶在烧杯②中加入2种试剂后,即可观察到的现象为 ▲ ;
⑷通过比较上述3组实验,可以得出的结论为 ▲ ;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
① 试用一个离子方程式表示上述反应过程中的变化 ▲ ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com